柿谷 均
2019年の暮れ、中国湖北省武漢市に端を発した新型コロナウイルス感染症(COVID-19)は、翌2020年にはまたたく間に全世界に広がり、人類がかつて経験したことのないパンデミックが今もなお続いている。その一方でまったく新しいタイプのワクチンがわずか一年足らずのうちに開発された。これらが先進国を中心に供給されまた接種が進んだことにより、感染拡大に一定の歯止めがかかっている。日々各種メディアに登場するmRNAワクチンであるが、この中身が何であるかまたどのようにして作られているのかが語られることはほとんどない。本コラムではmRNAワクチンの工業製品としての側面にフォーカスし、その物質的基盤と製造法について解説する。
1.mRNAワクチンの夜明け
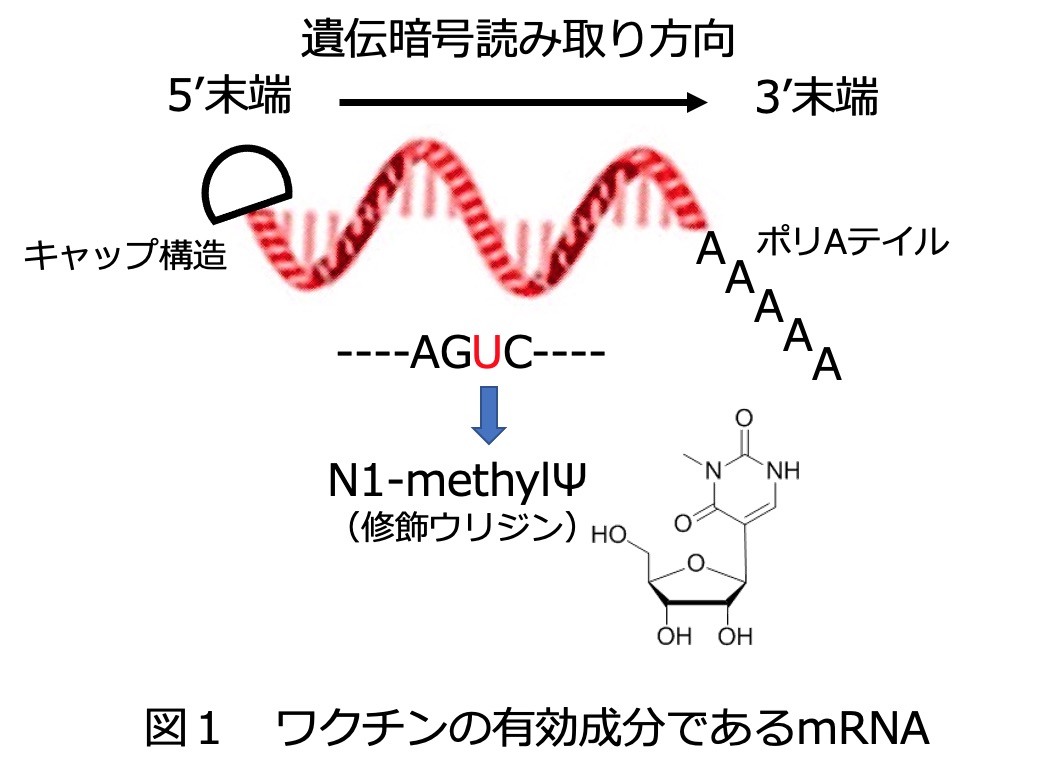 mRNA(メッセンジャーRNA)とはDNAに書き込まれた遺伝暗号の一部を写し取った分子であり、DNAが二本鎖のらせん構造を取っているのに対してmRNAは一本鎖の核酸である。COVID-19感染予防に用いられるmRNAには、新型コロナウイルス表面のスパイクタンパク質の合成を指示する遺伝暗号が書き込まれている。
mRNA(メッセンジャーRNA)とはDNAに書き込まれた遺伝暗号の一部を写し取った分子であり、DNAが二本鎖のらせん構造を取っているのに対してmRNAは一本鎖の核酸である。COVID-19感染予防に用いられるmRNAには、新型コロナウイルス表面のスパイクタンパク質の合成を指示する遺伝暗号が書き込まれている。
mRNAをワクチンとして利用するという考えは古くからあったが、mRNAは極めて不安定でありまた単独では細胞に入らないなど様々な問題を抱えており、実用化はチャレンジに満ちたものであった。人工的にmRNAを細胞内に入れたとしても速やかに分解され、mRNAが指令するタンパク質の合成もまたブロックされる。こうした一連の反応はウイルス感染に対抗するため人体に備わったメカニズムであり(それ自体有難いことなのだが)、これをかいくぐることは極めて困難と思われた。ところが2005年になされた発明が解決の糸口となった。すなわちmRNAを構成する塩基を化学的に修飾すると細胞に見つかりにくくなること(ステルス効果)が示されたのである。2015年にはウリジンのN1-メチルシュードウリジン(Ψ)への置換が特に有効であることが分かった。この修飾ウリジンで置き換えられたmRNAは試験管内で容易に合成できる(後述)。さらにはこの置換によりmRNAが安定化し、しかもタンパク質合成が促進されることが分かった。こうした知見によってmRNAワクチンは一気に現実味を増したのである。
2. LNP(リピッドナノパーティクル)という名の鎧
二つ目の大きなチャレンジである細胞への送達は脂質をベースとする材料設計によって実現した。表1にはファイザー/ビオンテックとモデルナによって開発されたワクチン(それぞれファイザーワクチン、モデルナワクチンと略称)の構成成分に関する比較を記す。両社のワクチンはmRNAの設計に関してほとんど同じで、違いは主に脂質成分にある。裸のmRNAは極めて安定性が低く、またポリアニオンであるため細胞膜を透過しない。この問題を解決するために開発されたのが数種類の脂質からなる構造体でありLNP(リピッドナノパーティクル)と呼ばれる。脂質の中でも特に重要なのはmRNAの電荷を解消するカチオン性の脂質と、LNPの外側に親水性を付与するPEG-脂質であり、多くの脂質が新たに合成されて組成の最適化がなされた。
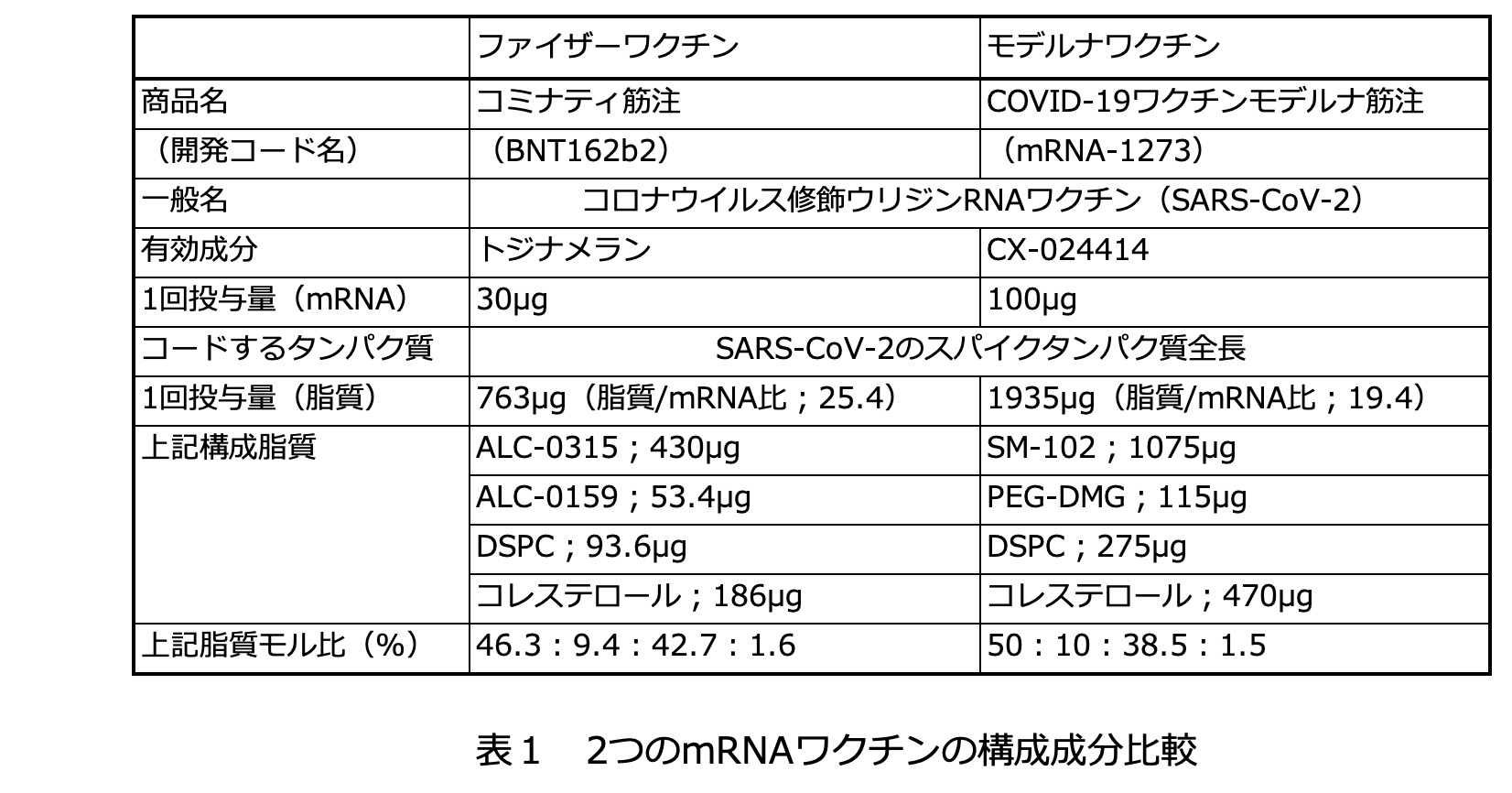
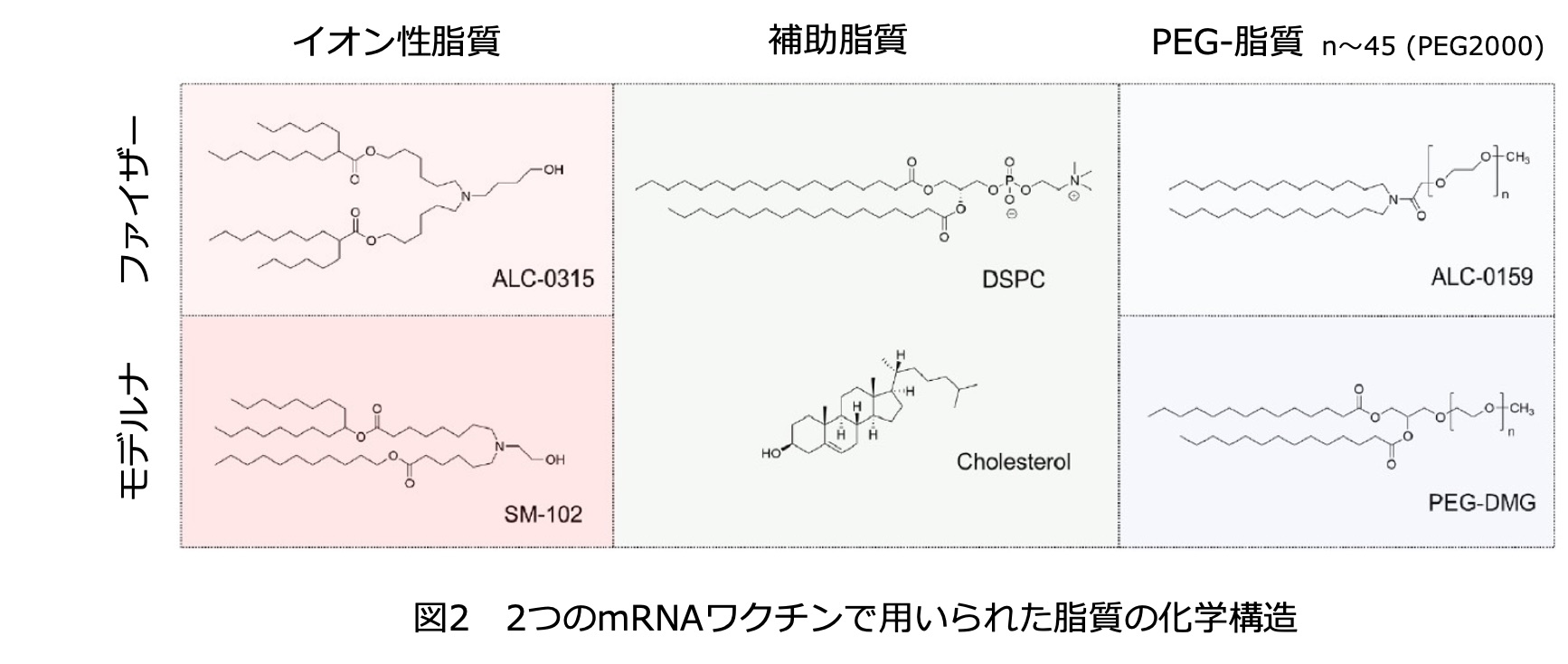
でき上がったmRNAワクチン(mRNA-LNP)は細胞に取り込まれやすい大きさ(約100nm)になっている。内部構造の詳細はまだ十分に解明されていないが、概念的には図3のようなものと考えられている。

3. mRNAワクチンはどのようにして作られるのか
mRNAワクチンの最大の特長は、生きた細胞を使わずに化学合成(酵素合成を含む)で作られた化学物質だということである。このため細胞を培養するための様々な検討(培地や培養条件の最適化など)が不必要で製造にかかる時間もずっと短くて済む。開発した企業は製造法の詳細を明らかにしていないが、いくつかの文献から概要をうかがい知ることができるので以下に記す。
3-1. RNA合成ステップ
まずウイルスのスパイクタンパク質をコードする配列を持ったプラスミドDNA(環状二本鎖核酸)を制限酵素で直鎖状にし、これを鋳型にしてmRNAを酵素合成する。ここで用いる酵素はT7RNAポリメラーゼというものであり、基質としてはATP、GTP、CTPとともにUTPを修飾ウリジンに置き換えた化学合成基質を用いる。これが主要なRNA合成ステップであり、細胞を用いないことからインビトロ転写(IVT)とも呼ばれる。合成されたmRNAの安定性とタンパク質合成能を高めるには5’末端(図1の先頭部分)にキャップ構造という特殊な構造を付与する必要があるが、このプロセスはIVTと同時に行うこともできる。ここでも特殊な酵素と基質が用いられるが、詳細は省略する。
3-2. 精製及び製剤化ステップ
IVTは37℃、数時間の反応で完結するが、反応終了後の溶液にはmRNA以外に鋳型として用いたDNAやDNA-RNA複合体、酵素、未反応基質などが含まれている。この中で特にDNAやDNA-RNA複合体はワクチンの性能を低下させる要因となるので、分離膜やクロマト担体などを用いて除く必要がある。このステップは各社ともノウハウとして秘匿しているようである。次に純化したmRNAを原薬とした製剤化のステップに移る。ここでmRNA-LNPを製造するわけであるが、一般的な製剤化のイメージとは異なる極めてクリティカルなステップだと言って良い。まず4種の脂質をエタノールに溶かしておき、これにmRNAの酸性溶液を1:3の量比で加えることにより、mRNAとカチオン性脂質の複合体を形成させる。このあと希釈などでpHを徐々に上げていくと約100nmの大きさを持ったmRNA-LNPがエマルジョンとして生成する。脂質のエタノール溶液とmRNAの酸性水溶液を瞬時に混合することが重要であり、このためにマイクロ流路デバイスが用いられている。このプロセスが生産性のネックになっているようであり、今後の技術課題の一つと考えられている。
4.おわりに
ながらく想像上の産物でしかなかったmRNAワクチンが突如として実用化されたことには驚きを禁じ得ないが、その背景を探ると長年にわたる研究開発の歴史があり、コロナ禍という特殊事情で実用化に向けた技術開発が一気に進展した結果、日の目を見ることになったことに気づく。ワクチンはある種の公共財であり、先進国だけでなく開発途上国にまで行きわたらなければ本来の役割が果たせない。アメリカではPublic CitizenというNPOが新型コロナウイルスのmRNAワクチンを1年以内に80億回分製造するにはどれだけのリソース(ヒト、モノ、カネ)が必要であるかという試算を報告している。
https://www.citizen.org/article/how-to-make-enough-vaccine-for-the-world-in-one-year/
極めて現実味のある試算であるが、これを実現するには世界各地への技術トランスファーが必要であり、頑強で経済的な工業プロセスとサプライチェーンの構築も欠かせない。流通上の大きな制約になっている極低温での貯蔵・運搬がもし今後の技術開発で必要なくなれば、mRNAワクチンは間違いなく標準的な医薬品としての地位を獲得することだろう。
2021年8月16日
著 者:柿谷 均 (かきだに ひとし)
出身企業:東ソー株式会社
略歴:東洋曹達工業(現東ソー)に入社以降、一貫してバイオテクノロジーの研究開発に従事。相模中央化学研究所、玉川大学学術研究所を兼務。退職後に柿谷技術士事務所を開設
専門分野:遺伝子工学、酵素利用技術、微生物利用技術、プロセスクロマトグラフィーなど。理学博士、技術士(生物工学部門)。
*コラムの内容は専門家個人の意見であり、IBLCとしての見解ではありません