T. K.
近年、疾患を治療したり、服薬を管理したり、健康を維持したりするためのデジタル技術(アプリなど)が続々と開発されている。こうしたデジタル技術はデジタルヘルスと総称されているが、流通・販売に当たって薬事承認が必要となるものは「プログラム医療機器(Software as a Medical Device:SaMD)」、それ以外は「Non-Software as a Medical Device:Non-SaMD」に分類される。本稿では、ヘルスケア産業で注目を集めるデジタルヘルスの最新動向を紹介したい。
2010年に米国でWelldoc社が糖尿病の疾患管理用アプリを開発し、BlueStar®が医療機器として承認された。BlueStar®は、2010年にFDAで承認を取得した最初のモバイル医療用アプリである。BlueStar®は、患者が自宅で血糖値を入力する「記録」機能だけでなく、入力情報をもとに、医師から適切なタイミングで疾患指導や生活習慣・モチベーション維持に関するアドバイスが表示され、アプリ上で専門家に質問することが可能なシステムである。その後、治療領域毎に様々な製品が上市されており、デジタルヘルス製品としてFDA承認またはCEマーク(EUの安全基準認証)を取得した製品は2019年~2020年の1年間に60製品以上存在する。
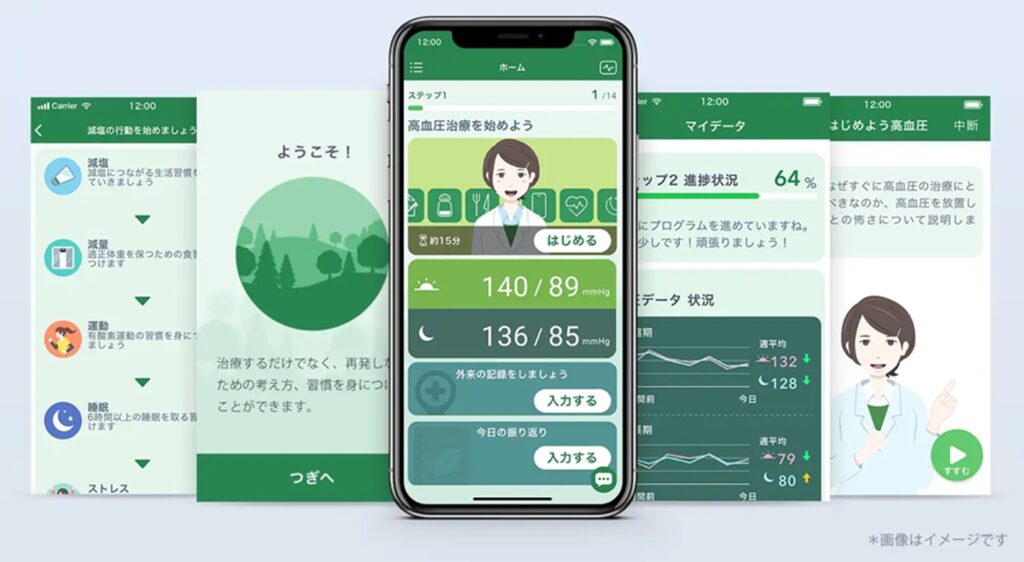
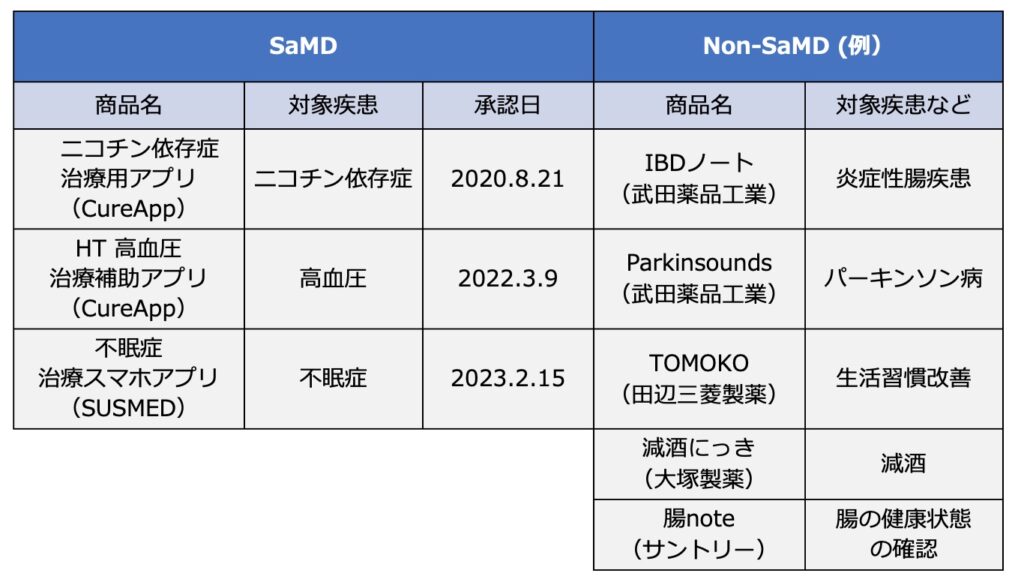
我が国では米国より10年遅れ、2020年12月に我が国初の治療用アプリとして、ニコチン依存症の治療用アプリ®「CureAppSC」が販売開始された。更に2022年9月に治療用アプリとして国内で2番目の承認となるCureApp社の高血圧治療補助アプリ(図1)が発売され、2023年2月にはSUSMED社が開発を進めていた不眠障害治療用アプリも国内3番目の承認を取得した。我が国ではSaMDと承認されたものは上記の3事例のみだが、Non-SaMDは数多くリリースされている(表1)。
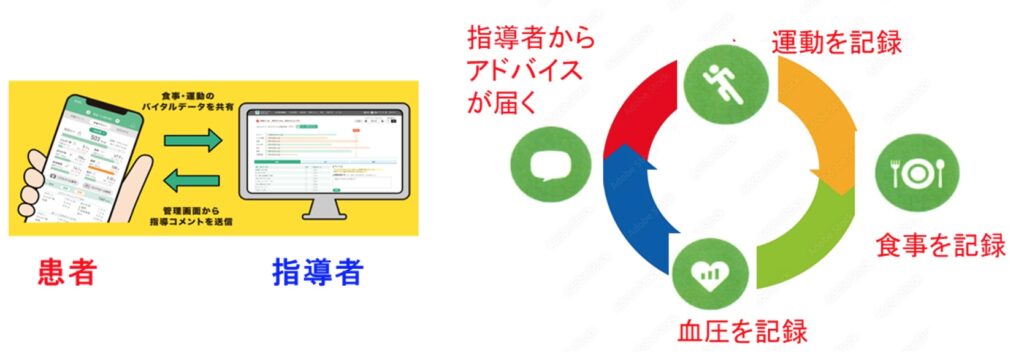
医師が処方する「プログラム医療機器(SaMD)」は、医薬品やハードウェア医療機器による従来の治療とは異なり、医師等のアドバイスに基づく「行動変容」を与えることにより症状改善を図るものである(図2)。ただし、治療の際にデバイスを使用する環境をそろえることや、インターネットを使用できない子どもや高齢者にどうやって使用法を覚えてもらうかという課題などがあることに加え、利用者への動機付けの仕方など普及へのハードルはまだ高い部分がある。
医療用アプリの開発はヘルスケア産業全般の中で注目度が増す一方で、収益化に課題を感じるとの声がある。薬事承認に要する期間を短縮するべく、二段階承認制度の導入や、新たな保険償還の仕組みを設置することが明言されているなか、2023年5月29日付け厚生労働省医薬・生活衛生局医療機器審査管理課通知(事務連絡)でプログラム医療機器の特性を踏まえた適切かつ迅速な承認および開発のためのガイダンスが発出された。
今後は世の中によりSaMD及びnon-SaMDなどのデジタルヘルスケアが浸透することによって、生活習慣病を中心とする病気の発症と重篤化の防止、効果的な診断・治療、適切できめ細かなフォローなど、 人々の生活の質の向上が図れていくと思われる。
2023年12月12日
著者:T. K.
大手医療機器メーカーに在籍(再雇用)
専門分野:酵素工学、天然物化学(微生物)、食品化学、医療機器、知財評価
資格等:博士(農学)、技術士(生物工学部門)、1級知的財産管理技能士(特許専門業務)
*コラムの内容は専門家個人の意見であり、IBLCとしての見解ではありません